Alle zugelassenen Impfstoffe sind gut. Warum das so ist und wie man das feststellt.
Seuchenkolumne. Nachrichten aus der vervirten Welt 363
Abonnieren Sie Armin Thurnhers Seuchenkolumne:
Heute erklärt Epidemiologe Robert Zangerle, warum alle drei zugelassenen Impfstoffe gut sind, wie das festgestellt wurde und warum eine endgültige Bewertung und Reihung erst in einigen Monaten vorliegen wird. A.T.
„ Ja, alle zugelassenen Impfstoffe sind sehr gut. Nein, sie sind nicht alle gleich (Hilda Bastian, The Atlantic).“
»In den bisherigen Studien zur Zulassung habe man sich darauf konzentriert, wie eine schwere Erkrankung durch die Impfung verhindert wird, sagte Ursula Wiedermann-Schmidt, die Leiterin des nationalen Impfgremiums in einem Interview vom 27. Dezember in der ZiB2. Mitte Februar, zu einem Zeitpunkt, als drei Impfstoffe zur Verfügung standen, konzentrierten sich viele Diskussionen um den Schutz vor schweren Verläufen. ORF Science berichtete: Das wichtigste zum jetzigen Zeitpunkt der Pandemie sei es doch, schwere Verläufe zu verhindern, „und da zeigt sich bei allen jetzt zugelassenen Impfungen, dass die Wirksamkeit gegenüber den schweren Verläufen bei allen vergleichbar gut sein dürfte“. „Es gibt also sowohl bei den mRNA-Impfstoffen von Biontech/Pfizer und Moderna als auch bei dem Vektorimpfstoff von AstraZeneca so gut wie keine schweren Verläufe nach erfolgter Grundimmunisierung“ . Sicher, alle drei Impfstoffe sind sehr gut, dennoch ist es wichtig, dieses simplifizierende Statement etwas differenzierter zu betrachten.
Um diese Diskussion um die schweren Verläufe besser einordnen zu können, sollte man sich den Beginn der Impfstoffentwicklung noch einmal vor Augen führen. Ende April 2020 hat die Weltgesundheitsorganisation WHO die Zielgröße (target efficiency) für die Wirksamkeit für Covid Impfstoffe mit 50% ausgegeben, mit Optionen, wie das zu messen sei. Man könne die Reduktion einer symptomatische Erkrankung, eine schweren Erkrankung oder einer Übertragung von Corona Virus durch die Impfung messen. Im Juni folgte die amerikanische Zulassungsbehörde Food and Drug Administration FDA weitgehend diesen Vorgaben der WHO und später auch die anderen, wie die Europäische Arzneimittel Agentur (EMA).
Die Wahl unter diesen drei primären Endpunkten („primary outcome“) fiel den Impfstoffherstellern leicht: eine symptomatische Erkrankung war am leichtesten realisierbar, einerseits eine gewohnte Zielgröße und andererseits leichter und schneller in eine großen Studie erreichbar. Die Zielgröße „asymptomatische Infektion“ wäre zwar häufiger zu erwarten, aber das dafür notwendige häufige Screening auf SARS-CoV-2 wäre nahezu untragbar (und logistisch wohl kaum realisierbar) gewesen, vor allem zum Zeitpunkt als die Studien begonnen wurden. Die Impfstudien waren/sind deshalb im Design mehr oder weniger gleich: jede Studie sollte beweisen, dass zumindest 50% Wirksamkeit gegenüber dem Auftreten einer symptomatischen Erkrankung durch SARS-CoV-2 („primary outcome“) gezeigt werden kann. Mit anderen Worten, in einer großen Gruppe von Testpersonen sollten in der Gruppe der Geimpften mindesten halb so viele eine symptomatische Erkrankung bekommen, wie in der nicht geimpften Vergleichsgruppe.
Die Impfstoffstudien hätten natürlich auch schwere Erkrankung durch SARS-CoV-2, Krankenhausaufnahmen oder Tod als primäre Endpunkte wählen können. Dann hätten diese Studien aber viel länger gedauert und auch noch mehr Studienteilnehmer erfordert, um eine 50%ige Wirksamkeit zeigen zu können. Der statistisch einfache, aber in der Diskussion meist nicht bewusste Grund dafür ist, dass diese Ereignisse im Vergleich zur symptomatischen Erkrankung viel seltener sind. Zum Beispiel benötigt es um die 200 Infektionen, um einen Todesfall erfassen zu können. In der Studienplanung wurden „schwere Infektionen“ als sekundärer Endpunkt eingeschlossen. Da das Studiendesign aber nicht auf den sekundären Endpunkten basiert (d.h. zu wenige Teilnehmer zu diesem Zweck), können so definitive Aussagen nicht zuverlässig getroffen werden. Wirksamkeit der Impfung gegenüber Krankenhausaufnahmen oder Tod als sekundäre Endpunkte waren nicht in allen Studien vorgesehen. Deshalb sind alle Aussagen über diese sekundären Endpunkte mit großer Vorsicht zu tätigen, und die ging zuletzt zuweilen verloren. Zum Teil geschah dies durchaus wohlmeinend, um die Bevölkerung vom Nutzen der Impfungen zu überzeugen, aber auch aus falsch verstandener Furcht, ein Übermaß von Nuancierungen würde nur zu Missverständnissen führen. Nuancierungen sind jedoch den Menschen zumutbar, wie aus der Bewertung der Impfstoffe in der Öffentlichkeit ersichtlich ist. Diese Einschätzungen entsprechen dann aber selten „Nuancierungen“, wie die Debatte um die verschiedenen Impfstoffe zur Genüge zeigt.
Zusätzliche Verwirrung entstand, weil für die verschiedenen Endpunkte nicht immer die gleiche Gruppendefinition herangezogen wurde, d.h. jeweils der gleich Zeitpunkt nach Beginn der Impfung. Ich präsentiere hier zwei Tabellen, die ich der Analyse von Hilda Bastian entnommen habe die als Grundlage für einen Artikel in The Atlantic diente . Bei Novavax habe ich die Verlautbarung einer rezenten Pressekonferenz zusätzlich berücksichtigt Hilda Bastian begann in den 1980er in Australien als Aktivistin für Gesundheitskonsumenten, wo sie bald als autodidaktische Gesundheitsexpertin Furore machte und wichtige Initiativen gründete, darunter auch die Konsumenteninformation der Cochrane Collaboration (weltweites Netz für evidenz-basierte Medizin). Im Jahr 2004 wechselte sie nach Deutschland, um dort das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit aufzubauen, sie leitete am IQWiG die Abteilung Gesundheitsinformationen. Ab 2011 arbeitete sie für die amerikanische Regierung bei PubMed Health, einem Portal für systematische Reviews und Konsumenteninformation, das 2018 eingestellt wurde. Bastian kehrt nach Australien zurück und begann eine Dissertation am Institute for Evidence-Based Healthcare der Bond University in Australien zum Thema Faktoren zur Gültigkeit von systematischen Reviews und Metaanalysen und schloss 2020 ab. Ihre Expertise zu klinischen Studien ist sehr gefragt.
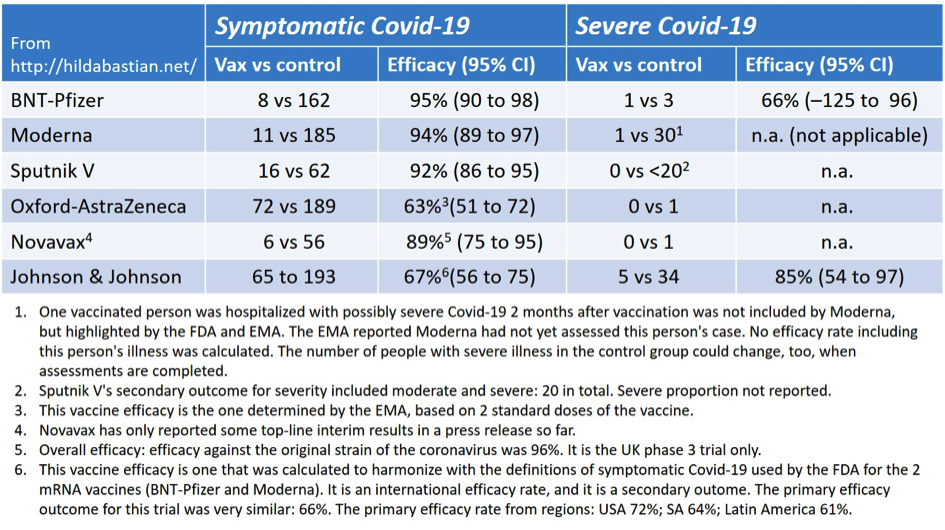
Vax steht in der Tabelle als Abkürzung für Vaccine/Vakzine, control für die Kontrollgruppe, fast immer Placebo, außer bei AstraZeneca, wo es die Meningokokkenimpfung war. Die Abkürzung „n.a.“ in den beiden Tabellen steht für „not applicable“ (nicht anwendbar), entweder, weil diese Wirksamkeit der Impfung das nicht vorsah oder weil es nicht berechnet werden konnte. Das wurde auch nicht im Nachhinein von Hilda Bastian gemacht. Wenn z.B. bei einer Gruppe keine Ereignisse („events“) vorkamen, so kann das Konfidenzintervall – Bereich der Unsicherheit um ein Ergebnis – nicht berechnet werden.
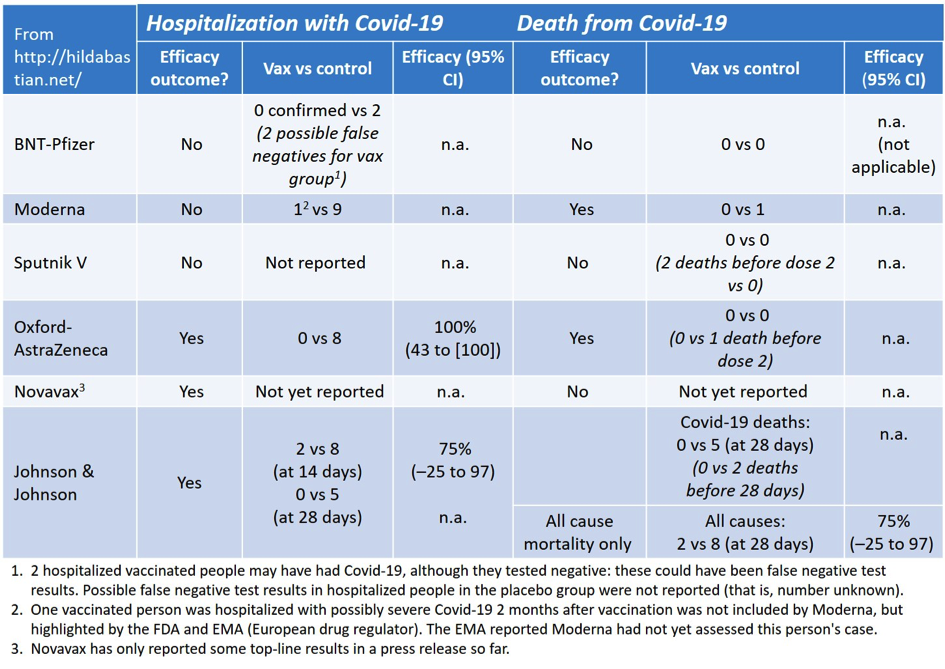
Die große Studie von Janssen (Johnson & Johnson) beeindruckt im Augenblick viele, auch weil hier zum ersten Mal eine nennenswerte Anzahl mit schweren Verläufen beschrieben werden konnte. So wurden 34 schwere Verläufe in der Placebo Gruppe und 5 schwere Verläufe in der Vakzin Gruppe beobachtet. Ins Krankenhaus aufgenommen wurden aber nur 5 der 34 Patienten mit schweren Verläufen und in der Vakzine Gruppe niemand. In der AstraZeneca Studie war es umgekehrt, lediglich eine schwerer Verlauf wurde in der Kontrollgruppe dokumentiert, während bei 8 Patienten eine Krankenhausaufnahme erfolgte, in der Vakzin-Gruppe jeweils niemand.
Daraus zuverlässige Schlussfolgerungen über die Wirksamkeit auf schwere Verläufe zu ziehen, ist nicht angebracht, weil bereits einzelne Fälle die Berechnungen der Wirksamkeit massiv verändern. Besonders fragil ist die Angabe der Wirksamkeit auf schwere Verläufe bei BioNTech/Pfizer, wo ein schwerer Verlauf unter den geimpften, gegenüber drei in der Placebo Gruppe, die Wirksamkeit auf 66% einschränken würde. Ein einzelner Fall macht hier einen Unterschied zwischen 66% und 100%! Eigentlich logisch bei so kleinen Fallzahlen, aber dennoch oft nicht bedacht. Es ist wichtig, daran zu erinnern, dass das frühe Ergebnisse sind, durchschnittliche Beobachtung betrug 2 Monate. Mit Fortdauer der Beobachtungszeiten werden die Fallzahlen größer werden und statistische Bewertungen möglich und zuverlässig(er).
Auch noch zu kurz sind die Beobachtungen nach dem roll out. Die Auswertung der Daten des größten Krankenversicherers aus Israel bestätigt im Wesentlichen die Ergebnisse der Zulassungsstudien. Man beobachtete 87% weniger häufige Aufnahmen ins Krankenhaus, gemessen 7 Tage nach der 2. Dosis. Ein glücklicher Umstand für die epidemiologische Forschung ist, dass die israelischen Krankenversicherer umfangreiche Daten zu ihren Patienten sammeln, dort ist die Digitalisierung des Gesundheitswesens sehr fortgeschritten. Das (d.h., die Erhebung von optimalen und maximalen Daten aus epidemiologische Sicht) wird auch als Hauptgrund für den vollständigen Zugang zum Impfstoff von offiziellen Stellen Israels festgehalten, neben einem minimal erhöhten Preis.
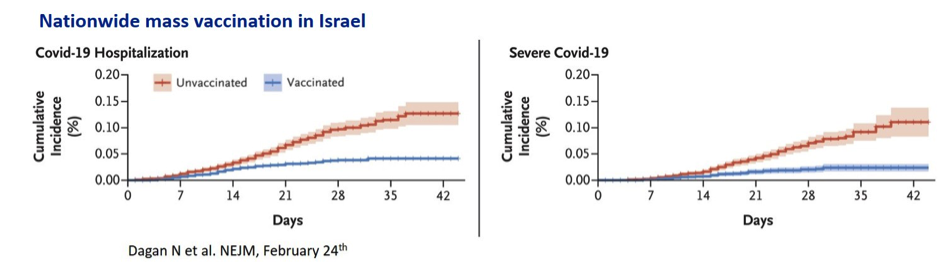
Auch aus Schottland und England gibt es Berichte über die gute Wirksamkeit der Impfstoffe, gemessen an Krankenhausaufnahmen. Eindrucksvoll vor allem der Bericht aus Schottland, wenngleich ein „früher“ Zeitpunkt der Überprüfung der Wirksamkeit gewählt wurde, nämlich am Tag 28-34 nach der 1. Impfung. Im Gegensatz zu Israel wird die zweite Dosis von BionTech/Pfizer in ganz Großbritannien „verspätet“ verabreicht, um möglichst viele möglichst schnell (zumindest mit der ersten Dosis) impfen zu können. Die Reduktion von solchen Krankenhausaufnahmen betrug für beide Impfstoffe gemeinsam 80% bei den über 80-Jährigen . Die Impfungen wirken! Aussagen, ob die Impfstoffe in Bezug auf Krankenhausaufnahmen gleich gut oder gar AstraZeneca besser ist, sind nicht gerechtfertigt, da die Bedingungen der verspäteten Gabe des BionTech/Pfizer Impfstoffs zu beachten sind und auch andere Störgrößen zu beachtet werden müssen. Die Autoren schlussfolgern, dass eine erste Dosis des Impfstoffs von AstraZeneca und BionTech/Pfizer Covid-19 bedingte Krankausaufnahmen substantiell reduzieren, nichts weiter.
Differenzierende Vergleiche zwischen verschiedenen Covid Impfstoffen sind derzeit nur sehr begrenzt möglich. Gar nicht möglich ist ein einfacher Zahlenvergleich. Jede Messung geht mit einer Ungenauigkeit einher, weshalb das Konfidenzintervall, der Bereich der Unsicherheit um ein Ergebnis, so zentral ist. Dann unterscheiden sich die Studien leicht in den Definitionen der Endpunkte, z.B. ein „schwerer“ gegenüber einem „moderaten“ Verlauf. Zusätzlich kommen demografische Unterschiede, so war die Zahl der Teilnehmer über 65 Jahre in der AstraZeneca Studie verhältnismäßig klein, weshalb die Zulassung für die Älteren erst nach Bekanntwerden der Daten aus Schottland gegeben wurde. Und dann wurden die Studien an unterschiedlichen Orten und zu unterschiedlichen Zeiten gemacht, wo die Rolle der Varianten eine ganz unterschiedliche war.
Aufgefallen ist erstmals die AstraZeneca Studie in Südafrika. Dort konnte kein Effekt auf mildere Verläufe für den Impfstoff ausgemacht werden; die Verhinderung schwerer Verläufe konnte nicht gezeigt werden (praktisch unmöglich, da die Impf- und Kontrollgruppe relativ klein und jung waren). Südafrika war wegen der reduzierten Wirkungen von Impfstoffen, die ganz rezent zur Anwendung kamen, „vorzeitig“ genötigt, ein Ranking vorzunehmen. Am 7. Februar beschloss die südafrikanische Regierung, den Impfstoff von AstraZeneca, lizenziert als Covishield vom Serum Institute of India, nicht zu verwenden, sondern den bereits eingekauften Impfstoff (eine Millionen Dosen) an die Afrikanische Union abzugeben, um ihn in Ländern einzusetzen, die nicht von B.1.351 betroffen sind.
Ein allgemeines und wirklich aussagekräftiges Ranking der Impfstoffe ist wohl noch einige Monate entfernt. Unsere Regierung hat ein solches Ranking mehr als vorzeitig bereits im Sommer 2020 gemacht, weil die niederen Preise von AstraZeneca allein als ein ausreichender Grund erschienen. Ein Trittbrettfahrerverhalten sondergleichen, hatte die Universität von Oxford doch dafür gesorgt, dass die ganze Welt einen erschwinglichen Impfstoff bekommt, dies war eine Grundbedingung für ihren Deal mit AstraZeneca. Ein beschämendes Verhalten Österreichs damals und heute.
Tatsächlich dauert es aber noch Monate, bis sich ein Ranking der Impfstoffe bilden kann. Aber das wird passieren, weil sich Impfstoffe unterscheiden, in der Wirkung auf die unterschiedlichen Endpunkte, in der Dauer ihrer Wirkung, in ihren Nebenwirkungen und in der Komplexität ihrer Anwendungen. Die mRNA Impfstoffe sind aufgrund ihrer Besonderheiten, wie Kühlkette, Empfindlichkeit gegenüber Erschütterung oder Scherkräften beim Aufziehen des Impfstoffes für den globalen Roll out weniger gut geeignet. Der Impfstoff von Janssen (Johnson & Johnson) lässt sich bei vergleichbarer Lagerung wie der Impfstoff von AstraZeneca leichter in der niedergelassenen Praxis verimpfen als AstraZeneca, weil dort aus einer Ampulle 5 statt 10 Dosen gezogen werden. Deshalb leichtere Organisation. Aber dieser Impfstoff war für das Gesundheitsministerium immer weit entfernt, die Seuchenkolumne berichtete darüber.
Im April werden Daten von BioNTech/Pfizer (und andere werden folgen) über weiter andauernde Beobachtungen als die bisherigen 2 Monate vorliegen. Das wird uns ein klareres und realistischeres Bild geben, wo nicht ein einzelnes Ereignis die Statistik massiv beeinflussen kann. BioNTech/Pfizer sind nämlich verpflichtet, einen diesbezüglichen Bericht am 31. März bei der EMA abzuliefern. Aber auch dieses Datum wird nicht das Ende der Beobachtungen bedeuten, womit sich das Bild zunehmend schärfen wird. Für jetzt bleibt aber die Einschätzung von Hilda Bastian richtig und relevant – und sollte auch so breit kommuniziert werden – „Yes, all of the COVID-19 vaccines are very good.« R.Z.
Distance, hands, masks, be considerate!
Ihr Armin Thurnher
